
 |
 |


|
最終更新日:2002/12/9



|
■自己組織化&自己集合
− 表面張力による造形
ひとりでにかたちを整える水滴

夏の蒸し暑い日に、冷たい飲み物をグラスに注ぐ。すると間もなくグラス表面に水滴が生じる。このとき水滴が粒状になるのは表面張力のためだ。面白いことに、固体表面上に形成する量子ドットの背景にはこれと似たような原理が潜んでいる。そこで自己形成する量子ドットの理解のために、表面張力の理解を深めておこう。 |
身の回りにあるガラスの上に少しだけ水を垂らすと、一度は薄く広がった水が集まってきてつぶれた球状になる。私たちはこの原因が「表面張力」にあることを知っている。確かにこの現象に対して、直感的に違和感を抱くことはないだろう。しかし、熱力学の第二法則によってものごとがランダムへと向かうことを考えれば少し奇妙な話だ。乱雑に広がっていたものが、より秩序だった球状になるとはどういうことだろう?少し丁寧にこのことを考えてはどうだろうか。当たり前だと思っていた現象でも、一度疑ってみたおかげでより深い理解が得られたということはよくあるものだ。
このささやかな疑問を解決するためには、「熱力学と自己組織化」で考えた「静的」な秩序化を思い出してみればよい。系の粒子の間に相互作用がはたらいている場合は、相互作用による安定化がエントロピーに打ち勝って、全体として秩序へ向かうということがある。では表面張力の場合、相互作用による安定化とはいったい何に相当するのだろう?
表面張力の起源
水滴はH2O分子が集合してできたものであるが、理想気体の場合と異なり、分子間には水素結合などの相互作用がはたらいている。したがって水滴内部では多くのH2O分子どうしが結合して安定化している。ところが水滴の表面では、当然のことながら結合する相手のいないH2O分子が存在しているわけで、結合による安定化エネルギーを無駄にしてしまっている。では、このロスを最小限にするにはどうすればよいだろうか?
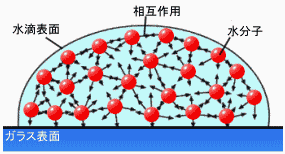
図.水滴を微視的に観察すると |
そのためには表面積を最小にすればよい。一般に同体積で表面積が最も小さい形状は球である。そう、表面張力によって水滴が自発的に球状になろうとするのは、安定化エネルギーを最大化しようとするためなのである。
ただし、水滴が表面張力の影響によって球状になるのはスペースシャトルの実験室くらいのもので、一般的にはこの理想的な形になっているわけではない。それは、何かしら表面張力と競合する要素が存在しているからだ。例えば、重力がその代表例で、地球上の水は球状にはならず、水たまりや大海へと押しつぶされてしまう。
固液界面での相互作用 -
表面張力との競合
表面張力と競合する要素として重力が重要であることは確かだ。しかしそれ以外にも注目すべき要素は存在している。例えば、きれいに洗浄したガラスに水を垂らすと薄い膜状に広がるのに対して、手の脂のついたようなガラスに水を垂らすと球状になる。これは重力だけでは理解できない。これを説明するためには、水とガラスの固液界面での様子を微視的に見てみる必要がある。
ここで二つのパラメーターを導入しよう。H2Oどうしの相互作用をDww(water-water)とし、H2Oとガラス表面を構成する分子(もしくは原子)との相互作用をDws(water-surface)としよう。
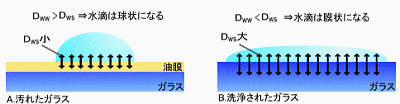
図.汚れたガラスと洗浄されたガラスの固液表面 |
まずは図のAの汚れたガラスに注目してみよう。油は疎水性なので、汚れたガラス表面にある脂肪分子とH2Oの相互作用による安定化は非常に小さい(Dws小)。したがってDww>Dwsとなり、表面張力のほうが固液界面での相互作用よりも支配的となって、水滴は球状となる。
では、図のBの洗浄されたガラスはどうだろうか?ガラスの主成分はSiO2であり、ガラス表面は負に帯電した二酸化ケイ素の非結晶構造がむき出したかたちとなっている。そのため、二酸化ケイ素の酸素原子と水分子の水素原子が強く相互作用する(Dws大)。結果としてDws>Dwwとなり、表面張力によって表面積を減らすよりも固液界面での接触面積を大きくする方が安定化するようになる。したがってきれいに洗浄されたガラス表面では水は薄い膜状に広がるのだ。
日常的にありふれた現象でも、このように少し注意深く観察すると、これまで知らなかった興味深い事実が浮かび上がってくる。さて、固液界面での相互作用の考え方を理解できたなら、次は固体表面に形成する量子ドットについて見てみることにしよう。
|
|
 |